Оглавление
Способы изменения жёсткости воды
Чтобы знать, в какую сторону производить изменения (повышать или уменьшать), определите жёсткость водопроводной воды и потребности ваших рыбок, может быть коррекции не потребуется вовсе.
Снижение общей жёсткости dGH
Способ № 1. Кипячение воды — поскольку в этом случае удаляется только карбонатная жёсткость, то общие значения изменяться не сильно. В зависимости от состава воды в вашем регионе колебания могут составить от пары процентов до 50% и более. Ориентируйтесь на потребности рыбок, возможно снижение жёсткости путём простого кипячения будет достаточно. Способ № 2. Вымораживание — данный способ актуален в условиях России с её длительной зимой. Воду заливают в ёмкость и выставляют на холод (например, на лоджию). Вода замерзает, начиная от стенок. В образующемся льде практически нет растворённых солей, они концентрируются в оставшейся жидкой воде, поэтому, когда лёд займёт 2/3 всего объёма, оставшуюся воду сливают, а лёд растапливают. В результате жёсткость снижается до 1-30dGH. Способ № 3. Пропустить воду через фильтр с обратным осмосом — вода после такой обработки очищается от всех примесей и становится практически дистиллированной. Перед применением в аквариуме полученную таким способом воду следует разбавить обычной водой. Способ № 4. Пропустить воду через ионообменные колонки — специальные смолы реагируют с солями кальция и магния, тем самым делая воду мягкой.
Повышение общей жёсткости dGH
Жёсткость воды повышается довольно просто, например путём добавления кусочков известняка в аквариум или использования фильтров с мраморной крошкой в качестве фильтрующего материала, или применение химических реагентов: — хлорид кальция (CaCl2), продаётся в аптеках без рецепта, является лекарственным средством, а также зарегистрирован как пищевая добавка Е509; — сульфат магния (MgSO4), продаётся в аптеках без рецепта, является лекарственным средством.
Что влияет на параметр?
Этот параметр напрямую зависит от исходной жесткости воды, температуры окружающей среды и других внешних факторов, включая интенсивность использования бассейна, количество и тип вводимых химреагентов и эффективность фильтрации.
Причины снижения
Накопление кислоты в бассейне достигается в первую очередь при передозировке средств для водоподготовки, в частности – при активном использовании кислотных реагентов на основе хлора. Помимо этого, стабильно низкий рН наблюдают при заливке бассейна чрезмерно мягкой водой.
В таких случаях достаточно сменить тип дезинфектора, лучше всего – на составы на основе гипохлорида кальция или натрия.
Почему растет показатель?
Накопление щелочи и рост рН происходит:
-
Из-за естественных причин – после попадания грязи от купающихся и размножения бактерий.
- При низкой эффективности фильтров или при ошибках на этапе водоподготовке при первичной заливке бассейна.
- При исходно большой доле солей кальция и магния и частом доливе такой воды в бассейн в жаркое время.
- При ошибках при выборе дозировки средств для нормализации рН-баланса.
https://youtube.com/watch?v=cUsyF2l3DH0
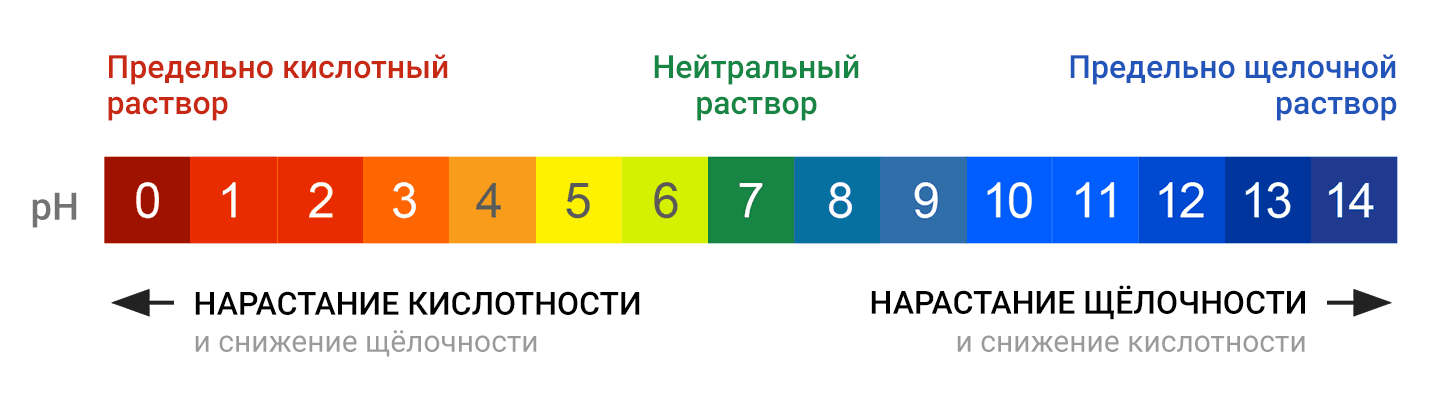
Что такое pH?
pH (произносится пэ аш), или водородный показатель, — характеристика водного раствора, описывающая меру его кислотности или щёлочности.
Значения на шкале pH располагаются от 0 до 14, с плавным переходом от предельно кислотного значения к нейтральному и далее, к предельно щелочному (или, как говорят химики, предельно осно́вному, от слова «основание»):
Значение рН напрямую связано с соотношением положительно заряженных и отрицательно заряженных ионов водорода в водном растворе:
Шкала рН является логарифмической. Это значит, что при изменении рН на одну единицу концентрация ионов изменяется в 10 раз. К примеру, раствор с рН 8 является в 10 раз более щелочным, чем раствор с рН 7. Раствор с рН 9 является в 100 раз более щелочным, чем раствор с рН 7, и т. д.
Пример для Raspberry Pi
В качестве мозга для считывания показаний с датчика рассмотрим одноплатные компьютеры Raspberry Pi, например, Raspberry Pi 4.
Исходный код
Запустите на малине скрипт, приведённый ниже.
troyka-ph-sensor-example-raspberry-pi-read-data.py # Библиотека для работы со временем и задержками import time # Библиотека для работы с расширителем портов GPIO Expander на плате Troyka Cap import gpioexp # Создаём объект для работы с расширителем портов exp = gpioexp.gpioexp() # Пин к которому подключен pH-датчик # Любой пин GPIO платы расширения Troyka Cap pinSensor = 3 # Коэффициент для вычисления pH calibrationFactor = 5.3 while True: # Считываем аналоговое значение с датчика кислотности жидкости adcSensor = exp.analogRead(pinSensor) # Переводим данные сенсора в напряжение voltageSensor = adcSensor * 3.3 # Конвертируем напряжение в концентрацию pH pHSensor = voltageSensor * calibrationFactor # Выводим показания датчика в консоль print(‘Voltage: ‘, voltageSensor, ‘ pH’, ‘Value: ‘, pHSensor, ‘ pH’) # Ждём 1000 мс time.sleep(1)
После загрузки скрипта, в консоль малины будут выводиться текущие показания кислотности жидкости.
Как проверить кислотно-щелочной баланс (pH крови)?

Физиологический показатель кислотности кровяной системы
По состоянию жидкости в кровяных сосудах можно узнать о здоровье. Водородный показатель крови смещается в сторону защелачивания или закисления. Косвенно дома узнаете о кислотности кровушки путём измерения меры кислотности мочи или слюны. Мера щёлочности кровки будет точнее. PH мочи здорового человека составляет 6,2 – 6,4. При закислении организма наполнение кислотой в моче равно 4,8 – 5,0, при защелачивании организма – 7,6 – 7,8. Кровяной состав здорового человека имеет pH = 7.35 – 7.45. Потенциал гидрирования крови и мочи определите в лаборатории.
Мера кислотности мочи показывает только реакцию вне клеток. Когда надо определить кислотно-щелочное состояние (КЩС) кровяных клеток, то сдайте анализы на содержание кальция в моче или калия в крови. Количества кальция в моче ниже 2,5 мэкв/л или калия в крови ниже 3,8 мэкв/л говорят о кислотном состоянии. Кислотность больных органов и тканей отличается от общих показаний.
Тело имеет несколько компенсационных механизмов (буферов) для поддержания динамического кровяного КЩС. Количественная мера активной кровяной кислотности мало зависит от питания и от других факторов. Только серьёзные болезни приводят к изменению меры кислотности. Диабетический кетоацидоз и почечная недостаточность приводят к ацидозу, а недостаточность лёгочной функции приводит к защелачиванию.

Буферные системы крови
Если у больного человека при употреблении кислотных продуктов самочувствие улучшается, то организм имеет высокий уровень щёлочи. Когда щелочные продукты питания вызывают улучшение состояния, то организм закислён. Если реакция отсутствует, то человек практически здоров. К сожалению, многие врачи не учитывают водородный показатель организма. В этой статье редакция «Путь к здоровью» приводит популярные методы и тесты определения водородного потенциала кровушки, мочи и слюны в домашних условиях.
Как нормализовать баланс?
Любые агрессивные химические препараты, а средства для приведения в норму кислотно-щелочного баланса относятся к таковым, в водной среде бассейна нужно применять грамотно.
Повысить уровень
Профессиональную химию для бассейна с целью увеличения кислотности применяют так:
- Отмеряют нужное количество реагента, сверяясь с таблицей дозировок (на упаковке) и полученным показанием рН при замере.
- Разводят порошок или концентрат в небольшом объеме (не более 2-3 л) холодной воды.
- Выливают рабочий раствор в воду по периметру чаши бассейна. Рекомендуется добавлять не все сразу, а только ¾. Так поступают, чтобы не переусердствовать и не допустить превышения ожидаемого показателя.
- Спустя 6-7 часов берут пробу воды и проводят тест на рН. Если нормальный уровень кислотности не достигнут, выливают остальную химическую жидкость в бассейн.
- Тестируют повторно через 6 часов.
При помощи соды повышают водородный показатель таким образом:
- Готовят требуемое количество соды из расчета 20 г на м3.
- Круговыми движениями высыпают в воду бассейна. Лучше порошок сразу добавить в скиммер.
- Оставляют на 6 часов, потом замеряют рН.
- Если показатели неудовлетворительны, то соду добавляют повторно.
- Процедуру повторяют несколько раз до получения нужного результата.
Понизить уровень
Специализированные препараты, понижающие щелочность, применяют так:
- Производят первичный замер уровня рН в бассейне.
- В соответствии с полученным значением по таблице дозировок отмеряют количество реагента.
- Если производитель в прилагаемой инструкции рекомендует сначала растворить сухие гранулы или порошок в воде, то это делают.
В большинстве случаев допускается высыпать вещество непосредственно в бассейн. Насос при этом должен работать, чтобы вода циркулировала.
- Через 6-7 часов, когда препарат равномерно распространится по всему объему бассейна, замеряют водородный показатель еще раз.
В качестве подручного средства для снижения рН-показателя в бассейне чаще всего используют соляную кислоту.
Алгоритм действий такой:
- Измеряют уровень щелочности рН-метром (предпочтительно) или лакмусовыми бумажками (таблетками).
- В стеклянную посуду отливают требуемый объем кислоты, рассчитывая для понижения на 0,1 рН по 0,3 л на 100 м3.
- Набирают примерно полведра воды из бассейна и вливают туда отмеренное количество химиката.
- Затем медленно выливают рабочий раствор в воду по всей поверхности бассейна (избегая попадания на металлические части). Водная поверхность при этом должна быть неподвижной, а насос выключен.
- Затем спустя 2-3 часа оборудование включают для прохождения полного цикла циркуляции.
- Еще через 4-6 часов опять тестируют рН в бассейне.
- При необходимости процедуру повторяют.
Внимание! При работе с соляной кислотой требуется неукоснительно соблюдать требования безопасности (не проливать, не допускать случайного попадания на открытые и незащищенные участки тела, оборудование и пр.), а также пользоваться средствами индивидуальной защиты.
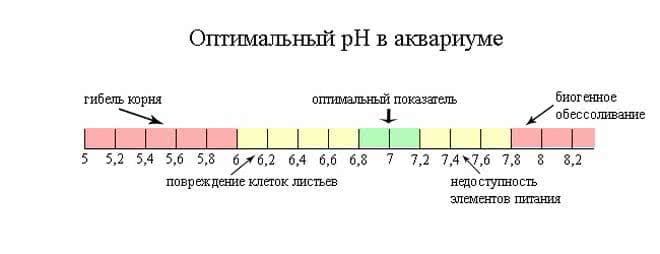
Как pH влияет на жителей аквариума
Большинство видов рыб относятся к несоответствию кислотности воды в аквариуме, если разница не слишком значительная. Но при размножении, например, икромечущих рыб, обязательным условием успешного разведения считается снижение pH в аквариуме.
Но некоторым видам нужен особенный pH. Рыбы из Амазонки и Африки лучше чувствуют себя в подкисленной воде при водородном показателе меньше 7. Морские рыбы живут в более щелочной среде с уровнем кислотности 7,5–8.
При описании условий содержания часто упоминают жесткую или мягкую воду. Жесткой вода считается при водородном показателе больше 8,5, а мягкой меньше 6,5. Ни жесткая, ни мягкая вода не полезны, выбирать лучше промежуточные варианты.
Отрицательное действие оказывают аммиак и ионы аммония, которые сопутствуют высокой кислотности. Аммиак выделяется из жизнедеятельности рыб. Для снижения концентрации аммиака помогут мощные фильтры или замена части жидкости.
Аммиак с помощью бактерий преобразовывается в нитриты, а после в нитраты, которые губительны для организма рыб. Чтобы определить уровень содержания нитратов, приобретите в зоомагазинах специальные тесты.

Виды
Различают общую жесткость, карбонатную и некарбонатную.
Общая (gH)
Общая жесткость (gH) — это суммарное количество растворенных в воде солей кальция и магния. В ней выделяют карбонатную (временную, растворимую) и некарбонатную (постоянную, нерастворимую) жесткость. По сути своей, общая жесткость — это совокупность растворимой и нерастворимой жесткостей.
Карбонатная (kH)
 Карбонатная жесткость (kH)характеризуется присутствием в воде гидрокарбонатнах и бикарбонатных анионов. Этот показатель называют еще щелочностью воды.
Карбонатная жесткость (kH)характеризуется присутствием в воде гидрокарбонатнах и бикарбонатных анионов. Этот показатель называют еще щелочностью воды.
Отличительной особенностью карбонатной жесткости является то, что карбонаты выпадают в осадок. В обычной жизни мы видим его в виде, например, накипи в чайнике.
При кипячении воды образуется углекислый газ, вода и карбонат кальция, который и выпадает в осадок. Так жесткость воды уменьшается. Такая же реакция происходит, если pH>8,3. Поэтому карбонатную жесткость называют еще временной: ее можно устранить путем кипячения.
Ее уровень обычно ниже, чем общей жесткости, однако, если понижать kH, то уменьшится и gH. Поэтому kH считается одним из наиважнейших показателей воды в аквариуме.
Дело в том, что, если в щелочную воду (с высоким показателем kH) добавить немного кислоты, ничего не произойдет: кислота попросту нейтрализуется, а kH уменьшится. В обратной же ситуации, если кислоту добавить в воду с низкой карбонатной жесткостью, то щелочность воды упадет до критичного уровня, при котором живые организмы могут погибнуть.
Некарбонатная
Некарбонатная жесткость — это постоянный показатель, который не изменяется после кипячения. Ее обеспечивают кальциевые и магниевые соли сильных кислот — сульфаты, хлориды и силикаты.
Показатели нормы
По правилам СанПин нормальный рН водопроводной воды из крана составляет от 6,5 до 8,5 единиц. Однако потребителю стоит помнить, что значение этого показателя может отличаться в зависимости от характера применения.
Таблица норм уровня pH воды
|
Отрасль применения |
Показатель pH воды |
|
Гидропоника растений |
5,5–7,5 |
|
Общественный бассейн |
7,2–7,4 |
|
Пивные напитки |
6–6,5 |
|
Безалкогольные напитки |
3–6 |
|
Химически – волоконное производство |
7–8 |
|
Красильно-отделочная |
6,5–8,5 |
|
Теплоснабжение |
7–8,5 |
|
Энергетика, паровые котлы |
более 8,5 |
|
Система водяного охлаждения |
6,5–8, 5 |


Помимо этого, известны и другие нормы данного показателя для разного типа воды, безопасные для человека:
- дождевой – менее 7;
- морской – 7,5–8,5;
- речной, озерной и других поверхностных пресных водоемов – 6,5–8,5.
Согласно требованиям норма чистой дистиллированной жидкости должна равняться от 6,5 до 8,5 единиц
Если брать во внимание pH талой воды, то он должен равняться 7. Последний должен быть нейтральным, а не щелочным или с высокой кислотностью

Нормы кислотности
У здорового человека нормальный Ph держится в диапазоне 7,32–7,45, что указывает на слабощелочную реакцию крови.
Данное значение свидетельствует, что концентрация ионов водорода соответствует норме и все системы организма функционирует на должном уровне.
Уровень кислотности несколько различается для артериальной и венозной крови. В первом случае его нормальное значение — 7,37– 7,45, во втором — 7,32–7,42 единиц.
Если значение Ph менее 6,8 и более 7,8, то это свидетельствует о развитии патологических процессов в организме. Кислотно-щелочной баланс нарушается и в результате заболеваний, влияющих на кровообращение.
Только при нормальном значении водородного показателя все системы и органы могут нормально функционировать, удалять отработанные продукты обмена.
Жёсткость воды
Жёсткость бывает двух видов:
- Карбонатная (временная);
- Некарбонатная (постоянная).
Соотношение этих показателей называется общей жёсткостью (gH).
Карбонатная жёсткость воды – это уровень бикарбонатных и гидрокарбонатных анионов. При высоком уровне кислотности (в щелочной воде) эти элементы выпадают в осадок. Такой процесс можно наблюдать, если кипятить воду с высоким уровнем kH: на дне посуды образуется накипь из карбоната кальция. В аквариуме его уровень повышается при pH выше 8,3.
У аквариумных рыбок требования к жёсткости разнятся. Одним нужна мягкая вода, другим жизненно необходим высокий уровень gH:
- 0-8 – вода считается мягкой;
- 8-14 – средний показатель;
- 14-30 – высокий уровень.
В неподходящей воде рыбы погибают из-за слишком высокого или слишком низкого уровня кальция, магния.
Как определить жесткость воды:
- Специальными тест-полосками;
- При помощи капельных тестов;
- С помощью дистиллированной воды и хозяйственного мыла 60% или 72%. Это целый химический опыт. 1 грамм мелко натёртого мыла растворяется в небольшом количестве тёплой дистиллированной воды. Мыльный раствор дополняют водой до уровня 6 см (для 60%-ого мыла) или 7 см (для 72%-ого). Затем в отдельной банке нужно смешать пол-литра воды из аквариума и мыльный раствор, вливая его понемногу, пока не появится белая пена. Оставшееся количество раствора в воде измеряют линейкой. Один сантиметр мыльного раствора равен 2 градусам жёсткости. Если в стакане было 7 см, а осталось 4, значит, жёсткость воды – 6 gH.
Как повысить жесткость воды
- Добавить более жёсткой воды (понемногу, регулярно повторяя замер).
- Кипячением обычной воды в течение часа, добавлять нижнюю треть из посуды, как и при изменении уровня кислотности.
- Поместить в аквариум предметы с высоким содержанием кальция: ракушки, кораллы, известняк.
- Добавить пищевую соду.
- Добавить хлористый кальций (10%) и сульфат магния в объёме 1 мл каждого.
- Добавить смесь магнезии и воды в пропорции 1 мл на 1 л.
Как понизить жесткость воды
- Добавить дистиллированной воды.
- Прокипятить воду и добавить в аквариум верхние 2\3 остуженной кипячёной воды.
- В больших аквариумах используются выносные фильтры с разными фильтрующими компонентами. Как смягчить воду в этом случае: добавить в фильтр торф, а затем – активированный уголь, который нейтрализует желтизну воды.
- Понизить карбонатную жесткость воды сложнее, чем повысить. На дно можно положить корягу для постоянного смягчения.
Устройство
Данный прибор это по своей сути является сложным измерительным устройством. Оно состоит из:
- Боросиликатной стеклянной трубки, которая является основным электродом. Стекло отлично проводит электрически ток, не подвергается изменениям при воздействии вредных химических составов.
- Хлорсеребрянного электрода для более точного сравнения показаний. Электрод является катализатором химической реакции при воздействии электрического тока.
- Блока управления и расчета показаний. Маленький компьютер со встроенной в память таблицей эталонных значений, в зависимости от модели с функцией сохранения прошлых результатов.
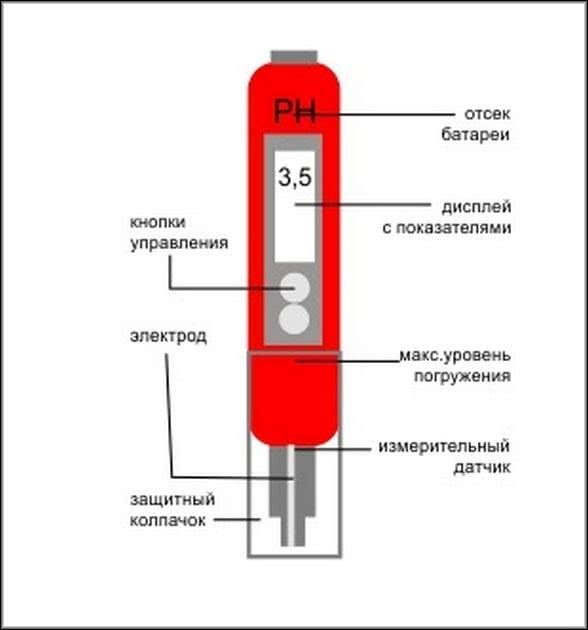
Существует 2 основных вида этих приборов: одноэлектродные и устройства с 2 электродами. Также pH-метры подразделяются на:
- Лабораторные, с самой точной системой измерения. Это наиболее совершенные приборы в данный момент. Позволяют производить вычисления и определение кислотности на молекулярном уровне из крайне сложной среды.
- Промышленные. Практически не уступают в точности лабораторным. Используются для определения вредных примесей в продуктах питания, в составах химии для бытового использования, на вредных предприятиях, с высоким уровнем химических выбросов в атмосферу.
- Бытовые. Их параметры измерения сильно занижены, по причине использования в менее агрессивных средах. Устройства используются для замера проб почвы на участках, исследования питьевой воды и продуктов питания, проверки вредности строительных материалов.
В дополнение к бытовым измерительным устройствам, прилагается эталонный раствор для сравнения показателей. Этот раствор состоит из воды с разной концентрацией ионов водорода, щелочей или кислот. Существуют растворы следующих типов:
- 1.65.
- 3.56,
- 4.01,
- 6.68,
- 9.18,
- 12.43.
Данные растворы помогут сравнить показания, полученные из почвы, воды или другой среды. Также помогут откалибровать устройство для получения самых точных показателей. В зависимости от концентрации подобные растворы можно смешивать между собой. Инструкция по смешиванию и получению необходимых концентраций часто прилагается к руководству пользователя.
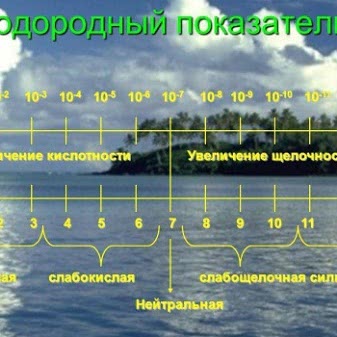
Каков нормальный pH воды
Нормальным водородным показателем считается примерный показатель кислотности крови рыб (7–7,5). Примерно этому показателю соответствует норма pH чистой жидкости без примесей.
Пресноводный аквариум
В пресноводных аквариумах изменяют какой-то параметр постепенно. Для этого часть свежей жидкости наливают в отдельный резервуар и дают некоторое время настояться. Если у пресной воды низкая кислотность, то в жидкость добавляют пищевую соду, которую заранее тщательно размешивают и отстаивают.
Морской аквариум
У морских обитателей уровень pH аквариумной воды важен и даже небольшие отклонения приведут к нарушению нормального состояния рыб. Оптимальный показатель pH — 8,2. Изменение водородного показателя не только прямо влияет на организмы рыб, но и косвенно. При понижении щелочности происходит кальцификация, затормаживающая построение скелета.
Щелочность повышается с помощью кальциевого реактива вместе с углекислым газом.
Но высокий pH снизить не так легко. При этом обязательно учитывайте уровень кальция, ведь резкие изменения этого показателя принесут больше вреда, чем повышенная щелочность.
Лучшие методы измерения pH продуктов питания
Определение лучших практик для измерения pH пищевых продуктов может вызвать некоторые проблемы в силу того, что существует большое разнообразие различных методов отбора проб, моделей рН метров и конструкции электродов. Однако есть определённые правила, при соблюдении которых измерения будут, по крайней мере, безопасными.
Несмотря на то, что весьма популярными являются индикаторные полоски и другие методы анализа рН, наилучшая возможная точность при исследовании пищевых продуктов достигается с использованием рН метра и электрода. Этот метод обеспечивает высочайшую степень точности, поскольку он менее субъективен, нежели химический метод испытаний, в котором для определения pH используются цветовые индикаторы.
Как измерить уровень кислотности?
Работы по корректировке водородного показателя начинаются с его измерения. Выбор метода и типа тестеров зависит от бюджета и назначения бассейнов.
Для разовых измерений для этих целей лучше подходят одноразовые тестеры (таблетки или тесты-полоски), при высоких требованиях к точности и частых замерах предпочтение отдается цифровому рН-метру.
В видео ниже рассказывается о том, как проверить уровень pH:
https://youtube.com/watch?v=m81DEo7OJLU
рH-метр
Принцип действия приборов для определения рН (например, Мегеон 17001) основан на измерении величины ЭДС, пропорциональной активности ионов водорода в воде бассейна. Большинство современных моделей оснащаются удобными цифровыми дисплеями и отражают значение показателя с высокой точностью.
Действия пользователя при этом минимальны: прибор погружается нужным концом в пробирку с небольшой (25-30 мл) пробой воды, после стабилизации (5-10 с, не более) показания снимаются и используются для принятия решения о корректировке. После применения и перед следующим использованием датчик промывается дистиллированной водой.
Минусов у цифровых рН-метров немного, но они есть. Приборы стоят дороже одноразовых тестов и нуждаются в периодической калибровке (проверочные растворы входят в базовый комплект) и смене батарей. Но при необходимости постоянного мониторинга они однозначно окупаются.
Таблетки
 Таблетированные средства для определения рН (например, DPD от HTH) продаются в запакованных блистерах и используются в комплексе с пластиковыми тестерами определенного объема от того же производителя.
Таблетированные средства для определения рН (например, DPD от HTH) продаются в запакованных блистерах и используются в комплексе с пластиковыми тестерами определенного объема от того же производителя.
Пошаговая инструкция по работе с ними:
Пластиковый тестер открывается и промывается чистой водой.
С бассейна берется проба воды с отступом от края от 50 см и от поверхности – от 5 см (точные параметры забора указываются в инструкции).
Пластиковый тестер ставится на ровное и устойчивое основание.
Из блистера прямо в емкость тестера с пометкой рН выдавливается таблетка
На этом этапе важно не касаться таблетки пальцами и не путать отделения (некоторые тестеры помогают одновременно измерить водородный показатель и степень содержания хлора в воде с помощью разных таблеток).
Тестер закрывается и интенсивно встряхивается до полного растворения таблетки.
Цвет раствора сверяется с эталонной шкалой, обычно располагаемой прямо на поверхности тестера.
После проведения измерений емкость тщательно промывается водой и просушивается. При появлении стойкого цветного налета на внутренних стенках тестер меняется на новый.
Важно! Блистер с таблетками и тестер берегут от солнечных лучей и перепадов температур. Потерявшие цвет или просроченные средства перестают растворяться или показывают неточный результат.
Лакмусовая бумажка
Одноразовые тестеры этого типа (например, от GARDEN SHOW) представляют собой полоски, покрытые кислотно-основными индикаторами, меняющими цвет при погружении в жидкую среду.
 Примером таких индикаторов служит лакмус, метилоранж и другие красители на органической основе.
Примером таких индикаторов служит лакмус, метилоранж и другие красители на органической основе.
Из-за изменения цвета только при смене типа среды и определенного интервала кислотности (1-2 единицы) на полоски обычно наносят смеси из 3-4 таких веществ.
Схема работы с такими тестерами простая:
- В чистый пластиковый стаканчик отбирается небольшое количество воды из бассейна.
- Край полоски опускается в воду.
- После указанного в инструкции временного интервала полученный цвет сравнивается с прилагаемой шкалой.
У большинства производителей универсальных тестеров для бассейна полоски становятся желтыми или красными при попадании в щелочную среду (т.е. при высоком рН) или голубыми или синими – в кислую, но точное значение показателя определяется лишь по шкале в инструкции или на упаковке. Используемые тестеры не пригодны для повторного использования, после получения результата их просто выбрасывают.
Внимание! При работе с одноразовыми тестами результаты измерений во многом зависят от цветового восприятия человека, характера освещенности и времени суток. Для получения точных результатов тестирование стоит проводить днем при нормальном освещении.
Виды ацидоза
Есть пять основных типов того, что врачи называют «метаболический ацидоз«. Это состояние означает, что организм имеет плохой кислотно-щелочной pH баланс или слишком усердно работает, чтобы поддерживать здоровый pH.
Диабетический кетоацидоз — иногда ошибочно путают с состоянием кетоз. Диабетический кетоацидоз возникает, когда организм человека с диабетом не справляется с изменениями своего состоянии и печень производит опасно высокое количество кетоновых тел. Обычно это состояние диагностируется, когда уровень сахара в крови превышает 13 ммоль/л.
Гиперхлорамический (hyperchloremic) ацидоз – часто диагностируемое достояние при обильной рвоте или диареи. При этой форме ацидоза происходит снижение уровня бикарбоната натрия и увеличение в плазме крови концентрации хлорида.
Молочнокислый ацидоз — слишком большое количество молочной кислоты может привести к ацидозу. Согласно научным журналам «причинами этого состония могут быть хроническое употребление спирта (алкоголизм), остановка сердца, рак, отказ в работе печени, снижение содержания кислорода в воздухе и низкий уровень сахара в крови». Кроме того, длительные физические упражнения могут привести к накоплению молочной кислоты в крови.
Почечный тубулярный ацидоз — если ваши почки не могут выделять достаточное количество кислоты в моче, кровь может стать кислой.
Жесткость воды (dH)
Жесткость является одним из важнейших параметров пресной воды, от которой зависит возможность содержания и разведение в ней рыб и культивировании растений. Пресная или соленая вода из естественных водоемов содержит определенное количество ионов кальция(Ca2+), который представляет собой один из самых необходимых элементов для водных ракообразных и моллюсков, использующих его для построения панциря или раковины, а также для рыб, у которых он входит в состав костей. Вода содержит также ионы магния(Mg2+). Содержащиеся в воде ионы Ca2+ и Mg2+ обусловливают жесткость воды. Вместе они показывают общую жесткость воды. В зависимости от жесткости вода подразделяется на очень мягкую до 1,5 мг-экв/л (согласно принятой у нас системе стандартизации жесткость воды выражают в ммоль-эквивалентах ионов кальция или магния, содержащихся в 1 л воды. 1 моль-экв соответствует содержанию в воде 20,04 мг Ca2+ или 12,16 мг Mg 2+.) на мягкую 1,5-4 на средне жесткую 4-8 на жесткую 8-12 и на очень жесткую свыше 12. Жесткость водопроводов не должна превышать 7. Чтобы содержать и разводить аквариумных рыб, нужно поддерживать определенную жесткость воды. В аквариуме, где содержатся рыбы и моллюски, жесткость воды постепенно снижается: кальций расходуется на построение раковин моллюсков, он усваивается рыбами и растениями. В пустом аквариуме жесткость воды повышается вследствие постоянного испарения воды, а также при переходе кальция в воду из грунта. Для смягчения воды можно использовать такие растения, как роголистник и элодея. Для увеличения жесткости можно добавить в воду небольшие кусочки известняка, мела, мраморную крошку, ракушки, хлорид магния и кальция. Общая жесткость (dH — от англ. выражения «Degrees of Hardeness» — «градусы жесткости»)
Измерить уровень dH
В продаже имеются препараты, позволяющие быстро определить общую и временную жесткость(KH) воды. Для этого в бюретку наливают определенное инструкцией количество воды и капают в нее по каплям препарат, слегка покачивая бюретку после каждой капли. Количество капель, пошедшее на получение окраски воды, цвет которой указан в инструкции, соответствует градусам жесткости.
Количество значений состава воды велико и мы не будем подробно описывать все характеристики водной среды, но вы можете ознакомиться с таблицей, в которой обобщены все характеристики водной среды, подходящие для содержания многих видов аквариумных рыб.
Какие есть нормы?
 Требования к воде для плавательных бассейнов прописаны в СанПиНе 2.1.2. 1188-03.
Требования к воде для плавательных бассейнов прописаны в СанПиНе 2.1.2. 1188-03.
Среда считается наиболее комфортной для купающихся и безопасной для эксплуатации при узком диапазоне рН, а именно – в пределах 7,2-7,4.
Допустимый для бассейнов минимум составляет 7,0, максимум – 7,6, при отклонении в обе стороны водородный показатель нуждается в регулировке.
Важно! При отклонении водного показателя в большую сторону в бассейне начинает накапливаться щелочь, что приводит к образованию кальциевых отложений, активному размножению микроорганизмов, поломкам фильтров, появлению неприятных запахов и помутнению воды. В воде с повышенным рН неприятно купаться из-за ощущения скользкости и раздражения кожи.
Повышенная щелочность
Повышенное содержание щелочи в организме также встречается, хотя и гораздо реже.
Проблема наблюдается у людей, которые часто употребляют лекарственные препараты с повышенным содержанием щелочи.
Излишняя щелочность также опасна. Она приводит к медленному усвоению пищи. Это может привезти к болезням кишечника, печени, кожи. Могут возникать аллергические реакции, обостряться хронические заболевания.
Особенно важно поддерживать кислотно-щелочной баланс в крови, лимфе, межклеточной и мозговой жидкостях. В этих средах отклонение pH от нормы (7,38-7,48) даже на 10% может спровоцировать опасные биохимические реакции, влекущие за собой развитие различных заболеваний.
Нормы ph для питьевой воды
Вода в природе имеет рН в диапазоне от 6,5 до 8,5. Чистая
вода полностью нейтральна, но, вступая в контакт с воздухом, реагирует с углекислым
газом и слегка подкисляется. Невозможно найти абсолютно чистую воду и,
следовательно, воды с нейтральным pH в природе нет: уже в источнике есть
растворенные соединения. Родниковая вода, которая считается очень мягкой, часто
имеет значение менее 7. В речных или родниковых водах преимущественно
бикарбонатно-кальциевый тип обычно является основным и составляет от 7 до 8.
Природная вода представляет собой разбавленный водный
раствор с переменным pH , в зависимости от кислотной или щелочной природы
веществ, растворенных в ней. Различные соединения, присутствующие в воде,
являются подкисляющими и подщелачивающими ионами, которые после растворения
активируют процессы, направленные на поддержание электролитного баланса
разбавленного водного раствора. В большинстве питьевой воды кислотно-щелочной
баланс контролируется балансом системы диоксид углерода-бикарбонат-карбонат.
Согласно рекомендациям, Всемирной организацией
здравоохранения pН воды используемой для питья имеет значения в диапазоне между
6,5 и 9,5. Этот диапазон был выбран, чтобы найти правильный баланс между
вкусом, запахом и прозрачностью, устойчивостью к загрязнению некоторыми
микроорганизмами и для максимального контроля присутствия некоторых металлов.
Например, железо или медь растворимы в воде при pH<7, в то время как
алюминий и цинк имеют pH> 10.

рН газированной воды зависит от концентрации солей.
Газировка получается добавлением углекислой кислоты в воду. Как правило,
увеличение содержания углекислого газа приводит к снижению pH, и наоборот, его
уменьшение – к увеличению значения.
Выводы
Значение pH воды имеет решающее значение не только для
выбора материалов трубопровода. Кислотная или щелочная ценность воды также
важна для здоровья человека, поскольку современные пищевые привычки склонны
снабжать организм большим количеством кислот. Основания нейтрализуют эти
кислоты не только в питьевой воде, но и в нашем организме
Это очень важно,
потому что в подкисленном состоянии эритроциты легко слипаются и транспорт
кислорода в организме значительно уменьшается. Чрезмерно подкисленная диета
оказывает негативное влияние на здоровье и ведет к хроническому дефициту
кислорода и зашлаковыванию клеток
Таким образом, правильный pH воды
способствует улучшению самочувствия.






